「根治」とは、治療後、長い時間が経過しても再発しないこと。その時間とは5年とも10年とも言われるが、実は10年経過後であっても非常に少ないながら再発はある。
では再発は、なぜ起きるのか?だが
前立腺癌において、再発が起きるのは「癌を取り残したか、癌を消滅させられなかったこと」によるもの。「再発」という言葉からは、一度癌が消滅した後に「再度癌が発生した」というニュアンスが感じられるが、そうではない。一度癌が消滅したなら5年や10年くらいでは再発は起きない。
その原因の多くは初回治療に起因するもの
つまり初回治療で消滅されられなかった「がん細胞」が増殖して、検査でわかるレベルまでになった段階が、いわゆる「再発」なのだが、完全には消滅していなっかたわけであるから、「再発」という言葉に違和感がないでもない。
→参照:再発とは、何なのか
では、再発しないためには「どの治療法が良いのか」となるのだが・・・おそらくこれを読んでいる方は、どんな治療法があるのか詳しくは知らないのが普通ですね。どんな治療法があるか知っていたほうが医師の話も理解しやすいでしょう。そこで前立腺癌の治療法を一気に紹介します、とりあえずざっと眺めてみてください。話はそれから・・。
手術療法 ■摘出
摘出手術
前立腺癌の摘出手術は全身麻酔をした上で開腹し、「前立腺と精嚢」を切除し摘出する。前立腺の中心部にある尿道ごと切除されるため、摘出の後、膀胱と尿道を直接つなぎ合わせる。さらに、根治性を向上させるため骨盤内の多数のリンパ節の切除(リンパ節郭清 ※1)をすることが推奨されている。この摘出によって失われるものがいくつかある。

da Vinci:画像:da Vinci Xi – Surgical System│Acibadem International
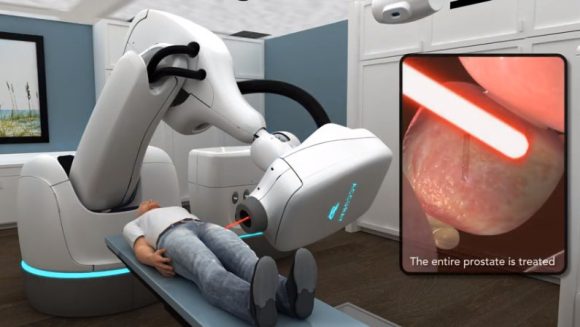
手術療法の選択肢は、おもに3つあり、泌尿器科医に普通に勧められるのがダヴィンチを始めとするロボット支援手術。上の写真は術中の医師だが、患者とは離れた場所でコンソールのスクリーンを見ながら操作しているところ。
摘出:ダヴィンチ:
ロボット支援手術は、現在の手術療法におけるメインストリームになっている。摘出する部位などはロボット支援手術でも従来と同じだが、「機能温存に優れ低侵襲」とされる。つまり、傷口が小さく痛みが少ない、手術後尿失禁の早期改善、勃起機能の温存など良い面も多い。
ダヴィンチでは、出血が少ないのも特徴だが、視野と手術操作に必要な空間を確保するため、炭酸ガスを患者のお腹に注入し圧力をかけるためである。医師はハイビジョン3D内視鏡によりロボットアームを操作して手術を行うという従来とは全く違う手法ではあるが、術者の養成期間は従来の手術よりも短かくて済むとされる。
しかしながら、ダヴィンチでは医師に触覚が伝わらないため、それを視覚で補わなければならない。高い根治性を得ようとすれば多くの症例をこなす必要があるが、ダヴィンチでは症例数が100以上あっても、さらに症例を重ねると根治性が向上するという報告もあり、医師の高い技量が必要とされることにかわりはない。現状では、根治性の高い手術を行える医師は限られるが、将来的には術者の技量の向上、改良されたシステムの登場などで、根治性においてもロボット支援手術が従来の手術を凌駕することになると思われる。
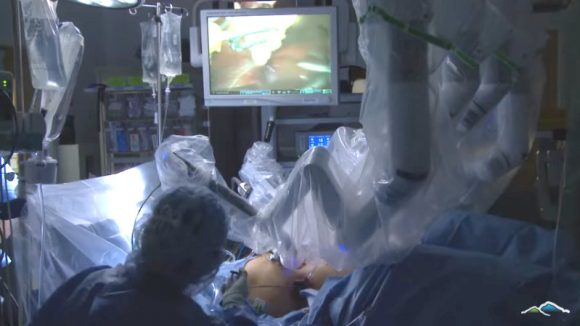
画像:VA Northern California Health Care System
上の写真は術中の患者の様子、わかりにくいかもしれないが中央部下に患者の腹部が見える。そこにビニールで覆われたロボットアームが刺されている。脇にいる人は医師ではなくおそらく看護師だと思われる。
摘出:ミニマム創手術:
従来の摘出手術より切開創を小さくして腹腔鏡補助下で行う開腹手術。炭酸ガスを使ってお腹を膨らませることはしないが、ハイビジョンを使った拡大視により精密な手術を行うことで、出血は少なく通常輸血を必要としない。機能温存にも優れる。根治性の向上のため、拡大前立腺全摘術+拡大リンパ節郭清を勧められることもあるが、その場合には勃起神経の温存はできない。
根治性という点でロボット支援手術より優れる可能性はあるが、その優劣より医療機関ごとの技量差のほうが支配的と思われる。ミニマム創では術者の高い技量が必要とされるためベテランの医師が多いと思われるが、その養成期間はロボットより時間がかるため、若い先生の多くはロボット支援手術を選ぶのではないかと思われる。
https://www.minimumendo.jp/gaiyou.html
摘出:開放手術:
従来からの摘出手術。ベテランの医師が多いとは思われるが、あえて選ぶ理由はない。ロボット支援下手術やミニマム創への移行で大きく減少していると思われる。
摘出:腹腔鏡手術:
低侵襲であるが、術者の非常に高い技量が必要とされる腹腔鏡手術では、術者の養成は非常に難しい。それを代替しようとしているのが、現在のロボット支援下手術あるため、この手術を積極的に選ぶ理由はあまりないかもしれない。現在、腹腔鏡手術を行っている病院でも将来的には新世代のロボット支援手術に移行すると思われる。
放射線療法 ■ 外照射
放射線外照射:
体を水平にして寝台に固定し、そのまわりをガントリーという放射線照射部が回転し前立腺に放射線を集中的に照射する。これによって、がん細胞の遺伝子にダメージを与え増殖できなくすることで、がん細胞を死滅に導く治療法。

画像:Varian Truebeam IGRT
写真では赤いビームが体を貫いているが、これはイメージであり、何も見えないし照射されたかどうかも感じない。「放射線のエネルギーで癌を焼き切る」というイメージを持たれている方もいるが、それは間違い。
IGRT(Image Guided Radio Therapy|画像誘導放射線治療)に対応したシステムであれば、治療システムの違いによる優劣はそれほどない。それよりも治療計画を立てる医療機関側の技量のほうが根治率に影響すると思われる。前立腺癌治療は普通、週5回x8、9週間程度だが、1回の線量を高くして照射回数を減らした寡分割照射もある。
→ 前立腺がんの放射線療法|ASTRAZENECA
→ 高精度外部放射線照射法の最前線│京都大学 溝脇尚志
外照射治療の種類は多いが、基本はIMRTという照射技術が使われる。その照射時間を短縮し精度を向上させたものがVMAT。SBRTは照射技術ではなく、1回の線量を増し照射回数を低減した照射法であるが、より高精度な照射が要求される。3D-CRTや4門照射は従来からある技術ではあるが、基本的に初回治療には使われない。
放射線外照射:IMRT(アイエムアールティー)▶ IMRT
強度変調放射線治療:治療患者の体を中心にして照射部を回転移動させ、多方向から(静止した状態で)自在な形状の照射を行い、局所にビームがより重複するように計画して線量を集中させる。現在の外照射治療の多くはこの手法が使われる。直腸への不必要な照射を軽減するために、2018年からはハイドロゲルの注入による直腸の移動が併用されることが多くなってきた。

Intensity Modulated Radiation Therapy (IMRT)
放射線外照射:VMAT(ブイマット):▶ VMAT: RapidArc
IMRTの応用型である、強度変調回転放射線治療。自在な形状の放射線を回転しながら照射することで従来のシステム(IMRT)より短時間で照射を行うことができ精度の向上が可能になった。主要な病院にはすでに導入されておりIMRTからVMATへと治療が移行しつつあると思われる。ハイドロゲルによる直腸の移動と併用される。
治療システム:バリアン トゥルービーム、エレクタ シナジー など(VMATに対応しているシステムでは、通常IMRT,3D-CRTを含むIGRT治療が可能)
放射線外照射:SBRT(エスビーアールティー):
定位放射線治療:VMATなどで高精度に強い線量を与え、従来より照射回数を低減した照射法。一部の大学病院等で実施されており、これからの照射法として期待がされる。こちらもハイドロゲルによる直腸の移動に加え、金マーカーの留置とともに実施されるようだ。
放射線外照射:3D-CRT(三次元原体照射法):
前立腺癌の初回治療としては過去のもの。
見る方向によって変化する腫瘍の投影像に合わせて、照射する放射線の形をそれに合わせることで、正常細胞への不要な照射を避けようとする照射法。ビームの形状は腫瘍の形に合わせるが、その強度は一定である。IMRTではビームの強度も変化させて、より組織への放射線の集中性を高め、周辺への不必要な照射を少なくしている。
放射線外照射:4門照射:
体の上 下 左 右から放射線を照射するベーシックな手法のこと。3D-CRT 4門照射として、小線源との併用治療や、再発後の救済照射などの使われることがある、照射範囲をシャープに絞る必要がない場合、安定した照射が可能。
放射線療法 ■ 外照射
放射線外照射:トモセラピー(←アキュレイ社の製品名):
多方向からの照射で局所に線量を集中させるIMRTの一種で基本的にVMAT専用として使われる。トモセラピーには放射線を自在な形状に絞る機能はなく、自在に変化させられるのは細いスリット(バイナリーマルチリーフコリメータ)から照射される細い帯状の放射線であるため、照射部を体を中心にしてぐるぐる回転させながら帯状に照射するが、同時にCTのように寝台をシステムの中に移動させる。これによって体には螺旋状に照射が行われることになるが、その合成が照射野となる。イメージしずらかもしれないが、CTで体をスキャンするのと似た方法で放射線を照射していると考えれば良い。
優れたピンポイント照射ができると広報されていることが多いのだが、トモセラピーの登場時期が早かったこともあってか、比較対象が1世代前の3D-CRTであることが多い。現在高精度な照射ができるのは、このシステムに限ったことではないため、このシステムを積極的に選ぶ理由はないと思われる。
治療システム:トモセラピー(アキュレイ)
放射線療法 ■ 外照射
ロボットアームの先端から放射線の細いビームを局所に対して自在な位置から照射する。画像では赤いビームが照射されているが、これはイメージであり何も見えないし何も感じない。SBRT(定位放射線治療)として、前立腺癌の治療に用いる病院も増加していると思われる。(この治療に関しては調査中)
これまでサイバーナイフ治療の米国の5年間治療成績(PSA再発率)では、低リスク群、中リスク群では、IMRTや小線源治療と同等と報告され、日本泌尿器科学会2016年前立腺癌診療ガイドラインでも、低、中リスク群については、従来法を置換できると認められています。
戸畑共立病院|サイバーナイフの治療成績
放射線療法 ■ 組織内照射
小線源療法(LDR、HDR)
前立腺内部に、多数の放射線源を挿入し、前立腺細胞に直接放射線を照射する。これによりがん細胞の遺伝子にダメージを与え、時間経過と共にすべての癌細胞を死滅に導く治療法。死滅させるのに十分な高い照射線量が必要とされるため、それを安全に与えるためには高い技量が必要とされる。医療機関によって技量差があり根治性に直結するため、小線源療法では高リスクでも高い根治実績のある医療機関で治療を受けるべき。
組織内照射は放射線療法の1つの手法だが,その特徴は強度変調放射線治療(intensity-modulated radiation therapy;IMRT)等のX 線照射に比べて生物学的効果線量(biologically effective dose;BED)に換算した照射線量が高いことにあり,それにより高い治療効果が期待できる
LDR は高線量の照射が前立腺に限局して行われるため,有害事象の発生率が低く,治療後のQOL を高く維持することが期待できる日本泌尿器科学会|がん診療ガイドライン│10 放射線療法(組織内照射)
小線源治療にはLDRとHDRがある、照射の考え方は同じであるが治療方法は全く別である。従来LDRは中間リスクまでHDRはおもに高リスク向けとされていたが、医療機関によってはLDRでも高リスク以上に対応できる。治療にLDRを使うかHDRかは医療機関ごとの考えかたの違いであるので患者が選択できるが、小線源の併用療法である外照射併用、トリモダリティのどれを適用するかは担当医の判断によるものであり、患者の選択ではない。
放射線内照射:低線量率密封小線源(LDR):
シードと呼ばれる低線量のヨウ素125を封入したピンを50~100本程度前立腺内に挿入し永久留置し、約6ヶ月に渡って内部から放射線を照射する治療法。治療後も放射線を出さなくなったシードが体内に残るが、体に害を及ぼすことはなく、その存在は知覚できない。
低線量というと治療効果が低いと思われるかもしれないが、そうではない。放射線治療の効果は線量と照射時間の積算であり、半減期2ヶ月のヨウ素125を使うため局所には非常に高い積算線量となる一方、強い線量なのは線源の周り5mm程度であるため、周辺臓器への影響は少ないという特徴がある。
放射線内照射:外照射併用小線源療法(LDR+外照射):
おもに、高リスクに対応するために、小線源治療130Gyに外照射45Gy(5週間程度)を併用する治療法、併用により小線源単独より更に高い線量を照射できる。
放射線内照射:トリモダリティ(LDR+外照射+ホルモン療法):
高リスク以上、超高リスクへの治療法で、組織内照射+外照射、さらに計画的にホルモン療法を併用する治療法。非常に高い悪性度であっても根治可能とされる。泌尿器科の医師、治療を計画する放射線治療医とも高い技量が要求されるが、外照射を併用することで、小線源自体の線量は比較的低くて済むため、(高線量)小線源単独療法よりは容易であり、安定した治療成績が期待できる。
→LDRトリモダリティ
放射線内照射:(高線量)小線源単独療法(LDR):
小線源+外照射(及びホルモン併用)の実績を元に、次のステップとして、患者の体への負担をできるだけ軽減するために、小線源だけで併用療法(外照射+小線源)に近い治療効果を得ようとする治療法。中間リスクだけでなく一部の高リスク患者にも適用されることがある。併用療法における小線源の線量に比べ、より高い線量を与える必要があるため、泌尿器科の医師、治療を計画する放射線治療医とも非常に高い技量が要求される。このため一部の医療期間でしか実施していない。
オーソドックスな 小線源治療
多くの病院では、(オーソドックスな)小線源治療が行われており、低リスクにしか適用していないが、これは照射線量が不足しているためである。このような病院では中間リスクには外照射を併用して成績を向上させようとしているが、小線源の線量不足を補えるものではないため、(オーソドックスな)小線源治療は受けるべきでない。ここで言う「小線源単独療法」とは全く別のものである。
放射線内照射:高線量率密封小線源(HDR):
RALSと呼ばれる専用の装置を用いて、LDRよりも1桁高い線量のイリジウム192線源を一時的に前立腺に挿入し、入院中、内部からの数回の照射のみで治療を完了する治療法。退院後は体内に放射線源は残らない。主に放射線治療医の技量に依存する治療と思われる。LDRは前立腺被膜内にしか留置できないが、HDRはその針を前立腺を串刺しにするように刺すため前立腺被膜外からの照射も可能である。周りに与える放射線の影響が強いため、高リスク、超高リスク向けに用いられることが多く、外照射併用、あるいはさらにホルモン治療を併用したトリモダリティ治療(HDRトリモダリティ)となることが多い。
画像:Varian Medical Systems
粒子線治療
前立腺に粒子線を照射して、がん細胞を死滅させる治療法。従来は高額であったが、現在は保険が適用されるため金額的には治療の敷居が低くなった。
粒子線治療
従来のIMRTなどの放射線治療における放射線は体表面に強く当たり、深いところでは衰弱してゆくのに対して、粒子線は深いところにエネルギーのピーク(ブラッグピーク)を作ることができる。この点において粒子線の物理的特性はX線より優れている。
しかし照射精度や位置合わせという実施に直接関わる面では、最新の放射線外照射治療システムに劣る場合もある。(粒子線治療でも古い施設ではガントリー(照射部分)が固定されていて、単純な2方向からの照射である。より新しい施設i-ROCK(アイロック)では高精度照射が可能になっていると思われます)
※ サガハイマットの重粒子線治療 参照
粒子線照射:重粒子線治療:
炭素イオンを、粒子加速器で加速しがん病巣に照射する
画像:東芝エネルギーシステムズ
粒子線照射:陽子線治療:
水素の原子核(陽子)を粒子加速器で加速しがん病巣に照射
薬物療法:内分泌療法
根治治療においては、放射線外照射治療における事前治療として用いられ、これは放射線の効果を増す働きを期待するものです。また、小線源治療では肥大した前立腺を縮小するために使われることがあります。転移のある患者さんに対しては標準的治療法ですが、CRPCへの移行が懸念されます。
内分泌療法は、男性ホルモンの産生を抑えることで、癌を含む前立腺細胞の活動を抑止してしまう治療法で、
まるで特効薬のように良く効きます。投薬後1月以上経過するとPSAは劇的に低下し、普通に1,2桁小さな値になります。しかし転移のある患者さんでは、長期間に渡って使われるため、いずれは効かない時が来てCRPC(去勢抵抗性前立腺がん)に移行します。CRPCに対しては抗がん剤が使われます。
前立腺がんの多くは、男性ホルモンの影響を受けて増殖しています。内分泌療法(ホルモン療法)は、男性ホルモンの分泌や働きを抑えることによって、前立腺がん細胞の増殖を抑制しようとする治療法。
前立腺がんの内分泌療法|ASTRAZENECA
薬物療法:内分泌療法の併用療法
男性ホルモン(テストステロン)の約95%は精巣から分泌されていますが、約5%の男性ホルモンは副腎より産生されるため、この、両方とも抑えてしまおうというのが併用療法でCAB(combined androgen blockade)療法またはMAB(maximal androgen blockade)療法と呼ばれています。
化学療法(抗がん剤)
通常、初回治療に使われることはありません。
男性ホルモンの分泌が抑えられているにもかかわらず、進行が食い止められない前立腺がんのことを「去勢抵抗性前立腺がん(CRPC)」といい、ホルモン療法の次の手段の一つとして化学療法が検討されます。
その他の治療法
■ 研究段階
HIFU
HIFUは超音波を前立腺の1点に集め、そのエネルギーで約90度に加熱することで組織を壊死させるもの、治療範囲の設定が難しいと思われる。一部の大学病院や医療機関で実施されている、保険は適用されない。一度の治療で効果が得られなければ再治療が可能なところが特徴であり、一部の医療機関では前立腺全体ではなく一部を治療するフォーカルセラピーへの応用が検討されているが、部分治療はいまだ研究段階に近い医療と思われるため、通常の選択肢とはならないと考えていい。
東海大学医学部付属病院ではHIFUを用いた前立腺癌標的局所療法」が厚生労働省の「先進医療B」に認定された 2023年02月01日
クライオセラピー(凍結療法)
国内では放射線治療後の再発患者に対するフォーカルセラピーとして慈恵医大、三木先生が研究を進めている。アルゴンガスを前立腺内に注入し「凍結し組織を壊死させるもの」ではあるが、その凍結領域を正確にコントロールするのが難しいと思われる。国内では症例数は非常に少ない。
→ 前立腺癌のフォーカルセラピーの現状と展望 PDF
PSMA-PET
PSMA-PETによる画像診断と、PSMAによるアイソトープ治療が期待されており、臨床試験も行われている。PSMA-PETによる診断では良い結果が得られているようではある。海外で行われているアイソトープ治療では、延命効果はあるようではあるが根治には至っていない。研究段階の治療であると考えて良い。
前立腺がんの再発・転移を高精度で検出する最先端画像診断
HIFU 高密度焦点式超音波
クライオセラピー 凍結療法
■ 治療法として確立されたものではない
前立腺がんに対する、免疫療法、ワクチン療法、温熱療法などは、治療法として確立されたものではない。インターネットでは、これらの広告をしばしば目にする、慣れないと非常に魅力的な治療に思えるかもしれないが、選択肢とはならない。惑わされないよう注意されたい。
△ がん免疫療法
△ 樹状細胞ワクチン療法
△ 温熱療法 など
△ 前立腺癌に対する、免疫チェックポイント阻害剤
参考リンク
[高信頼度]『前立腺癌診療ガイドライン』2016 年版 概要
日本泌尿器科学会で作成された『前立腺癌診療ガイドライン』2016 年版から,ガイドラインの概要,作成者名簿,CQ・推奨一覧,アルゴリズム,本文を掲載。
やや難しいが非常に良い内容である。できれば必要とする項目を、じっくり読んでいただきたい。
がん診療ガイドライン│4 病期・リスク分類・ノモグラム
がん診療ガイドライン│8 前立腺全摘除術
がん診療ガイドライン│9 放射線療法(外照射)
がん診療ガイドライン│10 放射線療法(組織内照射)
がん診療ガイドライン│13 ホルモン療法
日本癌治療学会│がん診療ガイドライン
[高信頼度]NCCNガイドライン 日本語版│泌尿器がん
全米を代表とするがんセンターで結成されたガイドライン策定組織 NCCN(National Comprehensive Cancer Network)が作成した、世界的に広く利用されているがん診療ガイドライン。信頼度の高い情報であるが、患者にはかなり難しい内容であるため、読まなくても良いと思う。
前立腺癌 2018 [PDF]│医療イノベーション推進センター
前立腺癌の手術と放射線治療
日本放射線腫瘍学会第30回学術大会(11月17-19日、大阪市)では、シンポジウム「最新エビデンスに基づく前立腺癌診療の現状と今後の展望」が開催され、前立腺癌治療の最新動向が報告された。このシンポジウムで紹介された、手術と放射線治療の最近の動向のレポート
高リスクの前立腺癌症例に対する小線源治療の現状は?│medical.nikkeibp.co.jp
前立腺がんの治療法一覧
説明は丁寧でわかりやすいので、とりあえずの知識として読むには良い。一見信頼できそうに感じるかもしれないが内容は検証が必要である。たとえば”小線源の適用はグリソンスコア6”であるとか、外照射治療では3D-CRTに対するIMRTの優位性を示すなど、一昔前の情報を掲載しているのは問題外である。それでもHIFE、ダヴィンチ手術、粒子線治療に関しては詳しい情報を掲載しているのが面白い。
前立腺がんの治療法一覧│ReasonWhy Inc
前立腺全摘除術 補足説明
ASTRAZENECAには、こう書かれているが、少し説明が足りない
前立腺全摘除術は、がんが前立腺内にとどまっている限局がんの患者さんにおいては、根治の可能性が高い治療法です。
局所浸潤がんの患者さんの場合は、はじめに内分泌療法でがんを小さくしてから手術を行ったり、手術の後に放射線療法や内分泌療法を行うことがあります。
→ 前立腺がんの手術療法|ASTRAZENECA
ASTRAZENECAは正しいが、がんが前立腺内にとどまっているかどうかは、術前の画像診断だけではっきりとわかるものではないと聞く。つまり「限局がん」であると診断された場合でも、術後にそうでなかった、と知らされることもあるので、限局がんと仮定すれば根治の可能性が高いと言っているに過ぎない。よって「根治の可能性が高い」を信じるべきではない。
局所浸潤がんの場合の説明で、「はじめに内分泌療法でがんを小さくしてから手術を行ったり」とあるが、術前の内分泌療法が根治性を向上させるというエビデンスはなかったように記憶している。また「手術の後に放射線療法や内分泌療法を行うことがある」としているが、これは一般的なことではない。これらは手術によって癌を取り切れなかった、あるいはその可能性が高い場合に、その救済治療として行われるものですから、実質、手術の失敗のリカバリーである。
サガハイマットの重粒子線治療
「がん病巣をピンポイントで狙いうち」、「特に重粒子線は、陽子線よりもさらに線量集中性が優れ、がん細胞に対する殺傷効果が2~3倍大きい」という記述を読めば、誰でも、殺傷効果が2~3倍大きい理想的な治療なら、根治性も2~3倍になると想像されると思います。もし本当にそうなら・・いくら払ってでもこの治療法を選ぶべきです。以下は、サガハイマットからの引用です。
重粒子線及び陽子線は、体の表面では放射線量が弱く、がん病巣において放射線量がピークになる特性(ブラッグ・ピーク)を有しています。このため、がん病巣をピンポイントで狙いうちすることができ、がん病巣にダメージを十分与えながら、正常細胞へのダメージを最小限に抑えることが可能です。
特に重粒子線は、陽子線よりもさらに線量集中性が優れ、がん細胞に対する殺傷効果が2~3倍大きいとされているため、照射回数をさらに少なく、治療期間をより短くすることが可能です。
→九州国際重粒子線がん治療センター (サガハイマット)
しかしながら、私はこう考える。
癌に対する殺傷効果が2~3倍大きいなら、正常細胞への影響も2~3倍大きいと考えるのが自然です。またブラッグ・ピークによって「ピンポイントで狙いうちする」としていますが、それはターゲット(照射対象)がきちんと固定されている場合の理論ではないか。
前立腺癌において、前立腺は隣り合う直腸や膀胱の動き、変形によって、絶えず少しづつ動いているとされます。放射線照射において、前立腺が一定の位置にあると期待できるのは2分くらいまでという報告もありますから、前立腺の位置をCTやレントゲンなどで特定後、短時間で照射を終えるのが理想です。
粒子線に限らず、IMRTなどの外照射でも同じですが、照射時間が終わるまでの時間が長いなら、動く範囲を想定してやや広めのマージンを取って照射するほかないわけです。このマージン内に前立腺に隣り合う直腸や膀胱の一部が含まれてしまいますから、それらの臓器に対しては「強力な殺傷効果が及ばないようにする必要性が生じます」。
つまり、重粒子線が理論上非常に優秀で、強力な殺傷効果を持っているにしても、その運用上は隣り合う直腸や膀胱への副作用が許容できる範囲に収まる線量でしか照射できない、ということになります。
前立腺に対して相対的に非常に高い精度で照射できるなら、より線量を上げられるということでもありますが、現時点において粒子線治療が通常の外照射(IMRT)を超える精度であるかどうかは疑問です。同程度の精度であれば、その効果も外照射を凌ぐというわけにはいかないでしょう。
サガハイマットの文には、「照射回数をさらに少なく、治療期間をより短くすることが可能」と書かれていますが、その通りでしょう。しかし肝心なのは、根治(完治)性です。外照射治療などの通常の放射線治療に対して根治性において優れているという記述は、なさそうです。
>>トップページに戻る
※ ページ一番上の画像をクリックしでもトップに戻れます。